CE/IVDR
IVDR - Checklist를 활용한 DoC 와 TD 검증
MDRA CAT
2024. 12. 19. 10:58
728x90
반응형
IVDR(체외진단 의료기기 규정, Regulation EU 2017/746)에서 요구하는 규정을 준수하기 위해선 방대한 양의 기술 문서와 평가 자료가 필요합니다. 특히, 적합성 선언(Declaration of Conformity, DoC)와 기술 문서(Technical Documentation, TD)를 체계적으로 준비하는 과정에서 IVDR Checklist는 검증 도구로 활용될 수 있습니다.
IVDR Checklist의 이점
- 체계적 문서 준비: 요구사항을 항목별로 분리해 문서 준비 과정을 효율적으로 관리할 수 있습니다.
- 준수 여부 확인: 각 항목에 대해 '제공됨', '누락됨', '적용되지 않음'으로 구분하여 검토.
- 리스크 최소화: 누락된 요소를 사전에 파악하여 규정 위반으로 인한 문제를 예방.
- 감사 준비: Notified Body나 규제 기관의 검토 과정에서 모든 요구사항을 충족했음을 입증.
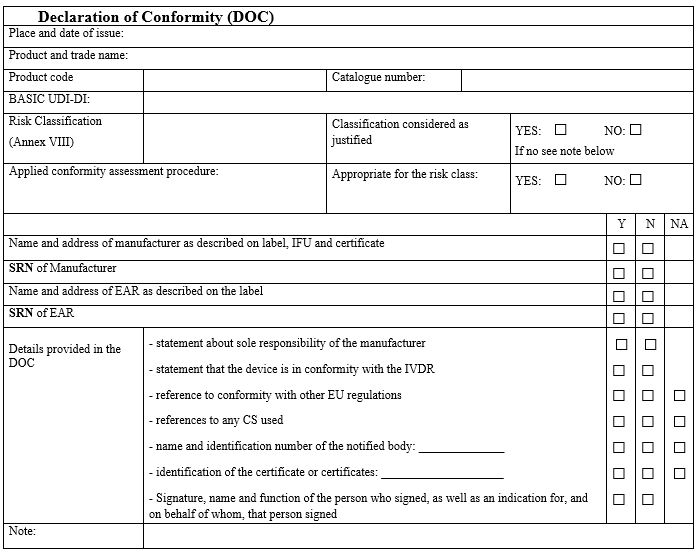
1. DoC(Declaration of Conformity) 검증
체크리스트는 DoC 작성 시 요구되는 주요 정보를 항목별로 분류합니다.
DoC 검증 항목을 통해 제조업체가 제품 적합성을 선언하기 위해 필요한 모든 정보를 빠짐없이 기재했는지 확인할 수 있습니다.
- 제조업체 및 대리인의 이름과 주소.
- SRN(등록번호) 및 UDI-DI(제품 식별 코드).
- CE 적합성 선언문 및 적용된 조화 표준.
- 서명 및 발행 날짜.
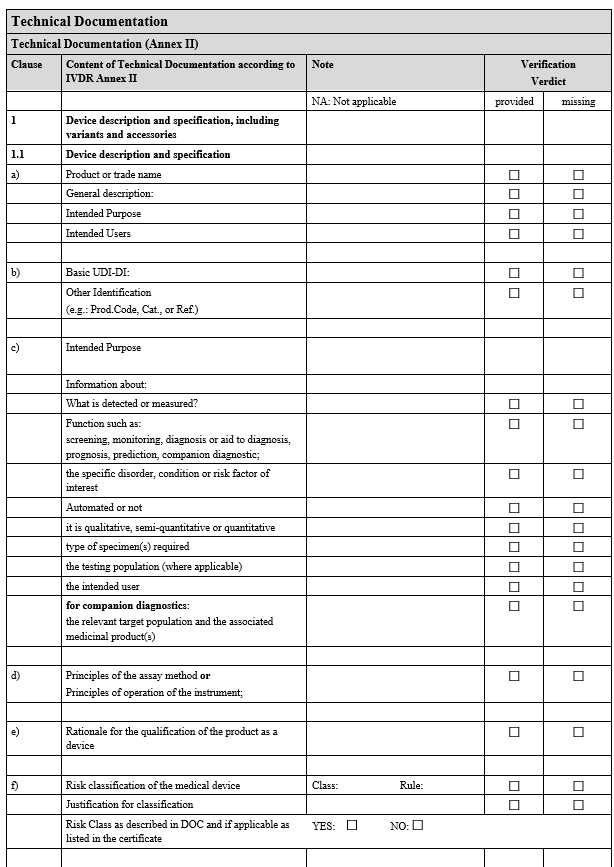
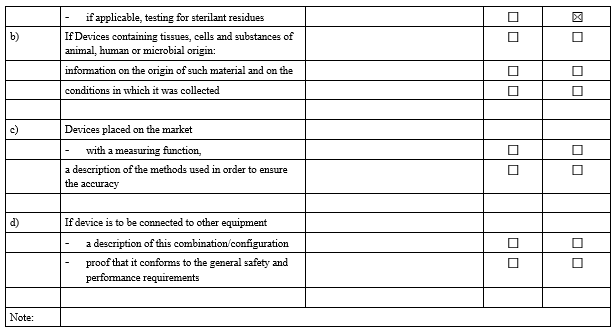
2. 기술 문서(Technical Documentation) 검증
IVDR Checklist는 IVDR Annex II 및 Annex III에서 요구하는 항목을 검토하고 준비 상황을 점검하기 위한 도구입니다. 이 체크리스트는 제조업체가 요구사항을 체계적으로 충족했는지 확인하고, 누락된 부분을 신속히 파악하는 데 도움을 줍니다.
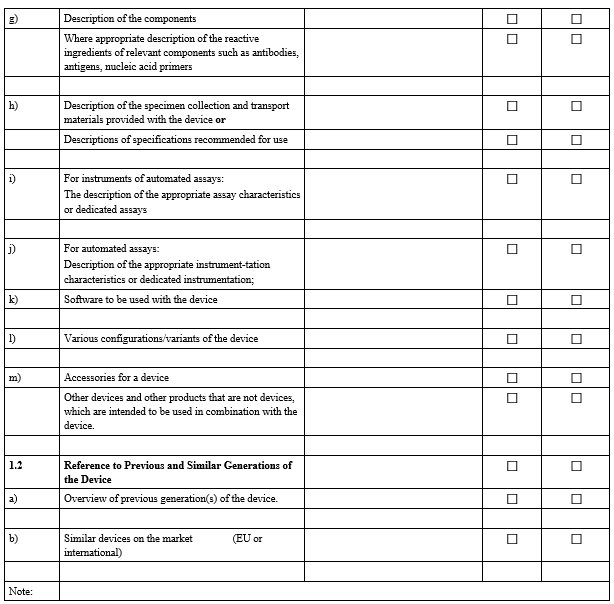
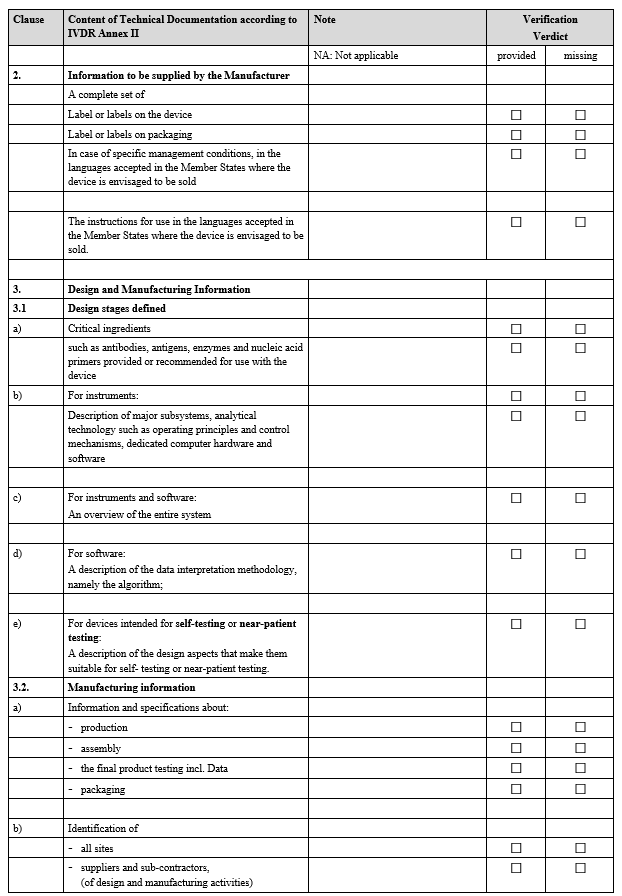
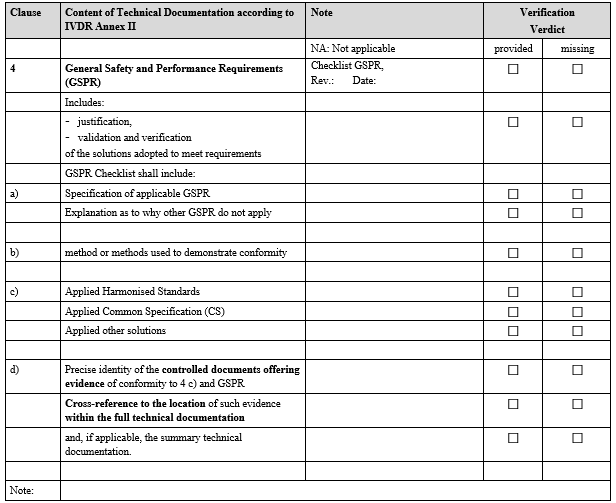
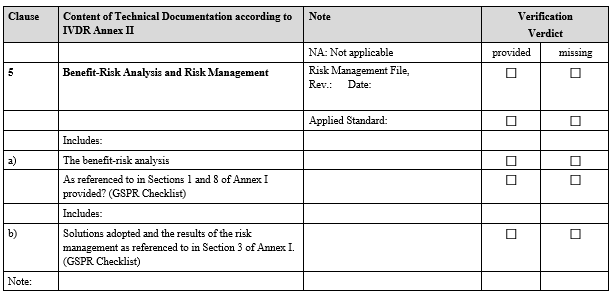
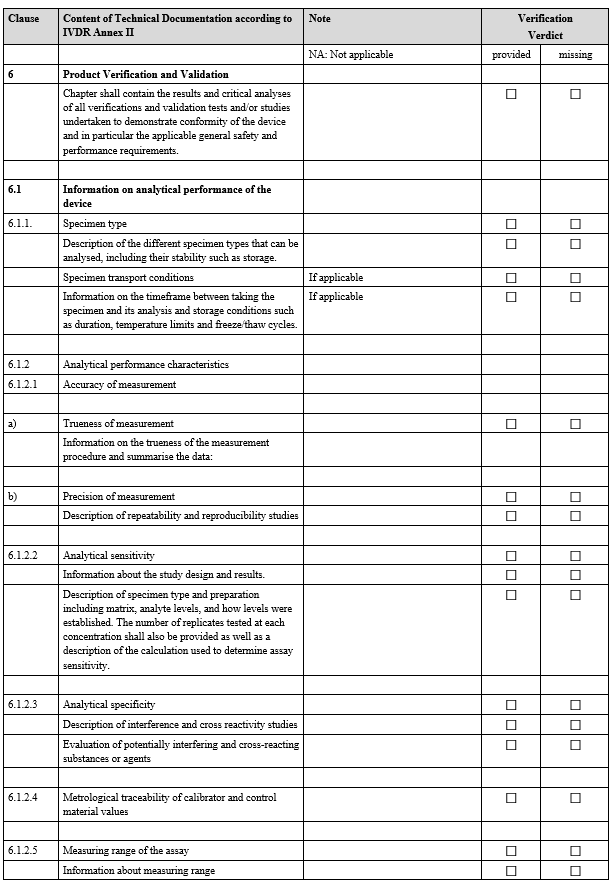
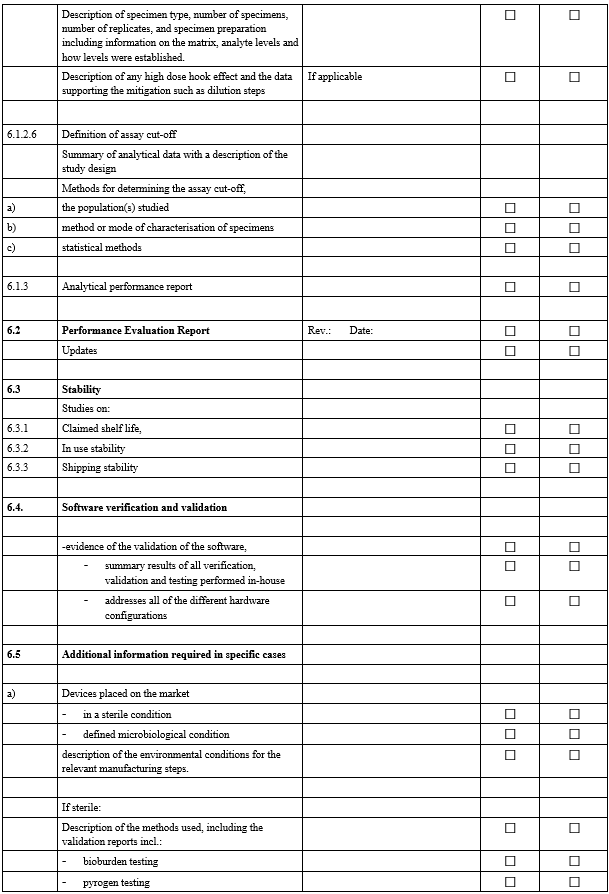
3. 사후 시장 감시(PMS) 검증
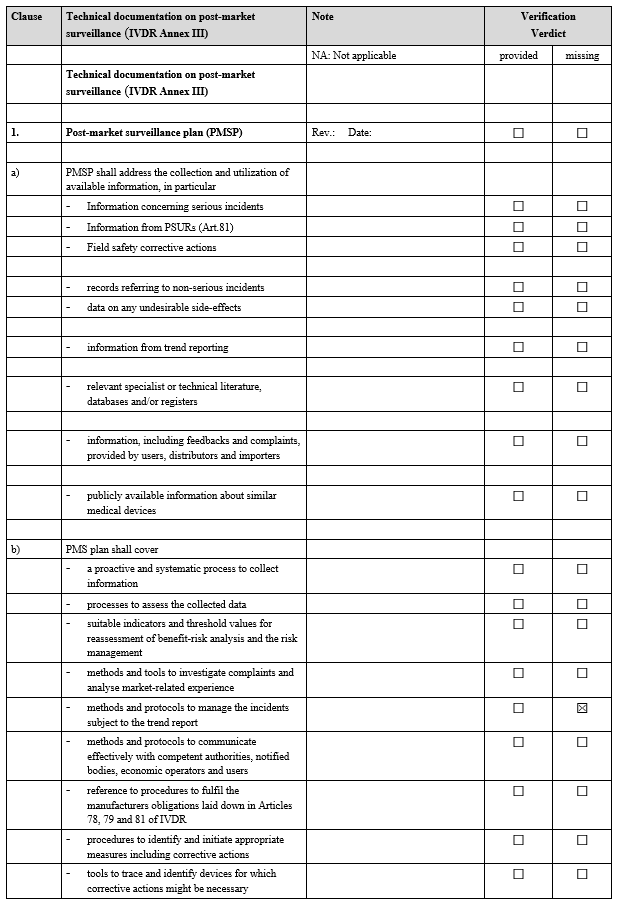

IVDR Checklist는 DoC 및 기술 문서를 준비하는 데 있어 제조업체에게 매우 유용한 도구입니다. 이를 활용하면 규정을 보다 쉽게 준수할 수 있을 뿐만 아니라, 품질 관리 및 규제 준수의 효율성을 극대화할 수 있습니다.
728x90
반응형