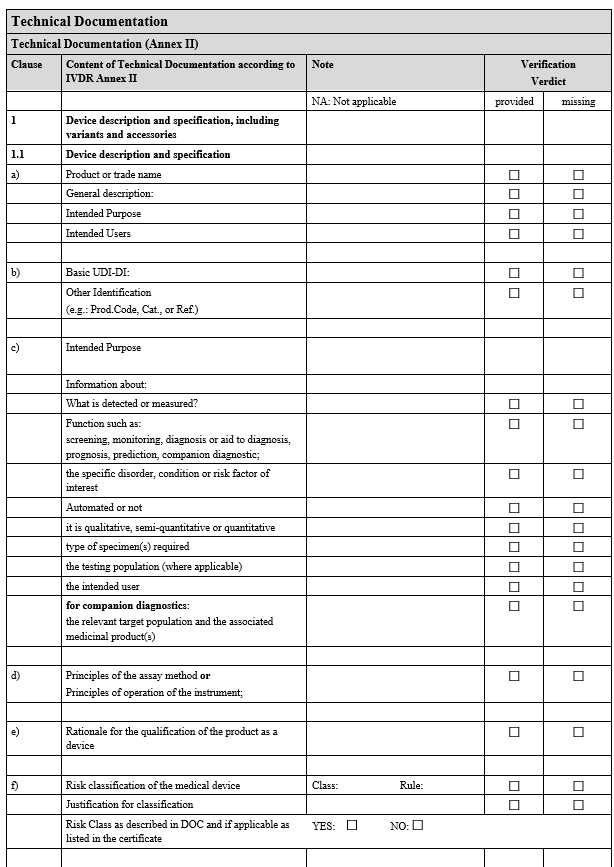
IVDR(체외진단 의료기기 규정, Regulation EU 2017/746)에서 요구하는 규정을 준수하기 위해선 방대한 양의 기술 문서와 평가 자료가 필요합니다. 특히, 적합성 선언(Declaration of Conformity, DoC)와 기술 문서(Technical Documentation, TD)를 체계적으로 준비하는 과정에서 IVDR Checklist는 검증 도구로 활용될 수 있습니다.IVDR Checklist의 이점체계적 문서 준비: 요구사항을 항목별로 분리해 문서 준비 과정을 효율적으로 관리할 수 있습니다.준수 여부 확인: 각 항목에 대해 '제공됨', '누락됨', '적용되지 않음'으로 구분하여 검토.리스크 최소화: 누락된 요소를 사전에 파악하여 규정 위반으로 인한 문제를 예방.감사 준비: No..