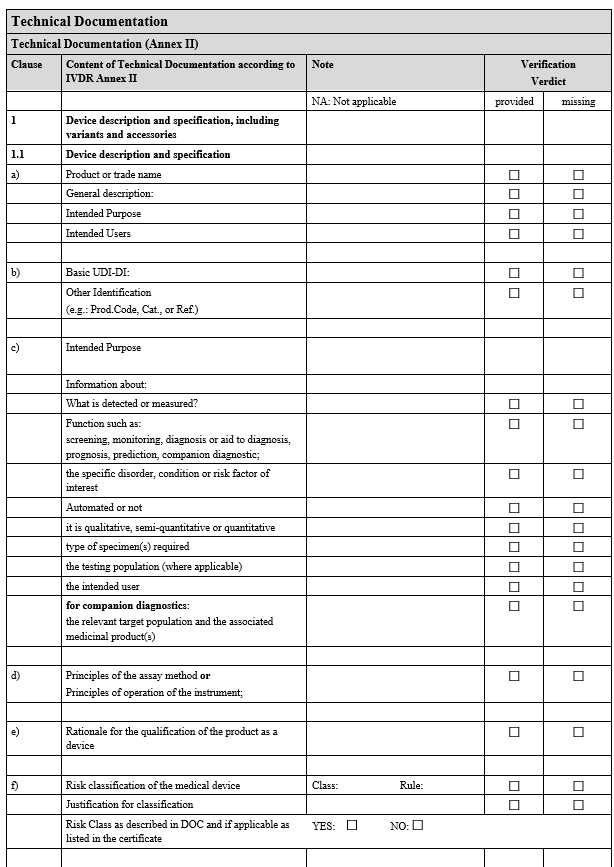
2025년 1월 20일, 도널드 트럼프 대통령이 제47대 미국 대통령으로 취임하면서, 그의 '미국 우선주의(America First)' 정책이 다시 한 번 주목받고 있습니다. 트럼프 행정부는 국경 보안 강화, 에너지 자립, 정부 개혁, 전통적 가치 회복 등 네 가지 최우선 과제를 발표하며, 미국의 이익을 최우선으로 하는 정책을 추진하고 있습니다. 한편, 유럽연합(EU)은 의료기기 규정(Medical Device Regulation, MDR)의 시행을 연기하기로 결정했습니다. 기존에는 2024년 5월 26일까지 MDR 인증을 받아야 했으나, 이번 결정으로 인해 관리 등급에 따라 2026년 5월에서 최대 2028년 12월까지 인증 기간이 연장되었습니다. 트럼프 행정부의 정책 방향트럼프 대통령은 취임과 동시..